抽象
涉及肌原性分化的分子机制相对众所周知。 通过基本螺旋 - 环 - 螺旋肌生成调节转录因子(MRF)的顺序激活来调节肌原性分化,并且生物力学信号在肌生成的调节中起重要作用。 在这项研究中,我们试图确定使用Gravite是否模拟失重文化 ® 可能会影响成肌细胞分化和MRF基因的表达。 尽管大鼠成肌细胞,L6细胞以孵育期依赖性方式分化为肌管,但在模拟微重力(10 -3 G)条件 下L6细胞的肌生成明显减弱 。 实时逆转录聚合酶链反应(RT-PCR)显示 Myog的 表达 在1G条件下 , Myf6 , Mef2c , Des 和 Ckm 以孵育期依赖性方式增加,并且 特异性地观察到 Myod1 表达在早期阶段瞬时增加。 然而, 在模拟微重力条件下 , Myod1 和 Myog的 表达 被显着抑制。 为了阐明分子机制,用5-AzaC处理L6细胞,并在1G或10 -3 G条件 下进一步与分化培养基一起温育 。 结果显示 Myod1 , Myog的 表达水平不同 ,以及在1G和10 -3 G条件下 肌管厚度的那些, 在该实验条件下完全消失。 通过连接介导的PCR(HELP)测定修饰的HpaII微小片段富集显示在模拟微重力条件下DNA甲基化状态的动力学变化减弱。 这些结果表明微重力 通过控制DNA甲基化来 调节肌生成和 Myod1 表达。
介绍
肌肉减少症被定义为与年龄相关的骨骼肌质量和力量的丧失。 从生命的第四个十年开始,症状随着年龄的增长而进步。 1 如果肌肉质量占体重的60%,骨骼肌的病理变化会对老年人造成严重影响。 然而,与年龄相关的骨骼肌萎缩和虚弱的治疗结果仍然未知。 2 , 3 , 4 的生肌分化过程的分子机制的理解将导致更好的治疗结果,因为肌分化的调节受损密切与年龄相关的骨骼肌功能障碍有关。 5 , 6 , 7 , 8 众所周知,肌原性分化受碱性螺旋 - 环 - 螺旋肌生成调节转录因子(MRF)的顺序激活调节:MyoD,Myf5,肌细胞生成素和MRF4(Myf6)。 9 , 10 , 11倍 的MyoD尤其是参与细胞与肌源性谱系的承诺。 12 , 13 , 14 已经报道,曝光成肌细胞或肌卫星细胞对机械单轴拉伸和拉伸的通过磁场,或电刺激,上调的MRF表达,导致肌形成的活化。 15 , 16 , 17 此外,在高度对齐的富勒烯晶须支架培养物上增强了成肌细胞的分化。 18 相比之下,成肌细胞分化的微重力培养抑制体外研究和空间飞行验证,表明生物力学信号在成肌的调控中发挥了重要的作用。 19 , 20 ,是显著的是2周后,太空飞行的宇航员的肌肉质量被高达20%的减少。 21
还已知DNA甲基化涉及肌源性基因表达和肌生成的调节:DNA-去甲基化剂5-氮杂胞苷通过上调的MyoD表达诱导肌生成。 22 , 23 , 24 , 25 BARRES等。 有趣的是,急性运动往往会减少整个基因组的全球甲基化,导致人体骨骼肌中受调节基因的激活。 26 辛格等人。 通过改变 DNMT1 , DNMT3a 和 DNMT3b的 表达,证明模拟微重力诱导人淋巴细胞基因组DNA的表观遗传变化 。 27 然而,空间飞行或模拟微重力对MRF基因的表观遗传变化和由此产生的肌细胞生成的影响仍不清楚。 因此,本研究旨在确定模拟微重力是否影响成肌细胞分化,MRF基因的表达和DNA甲基化的状态。
结果
微重力条件下肌生成的形态学评价
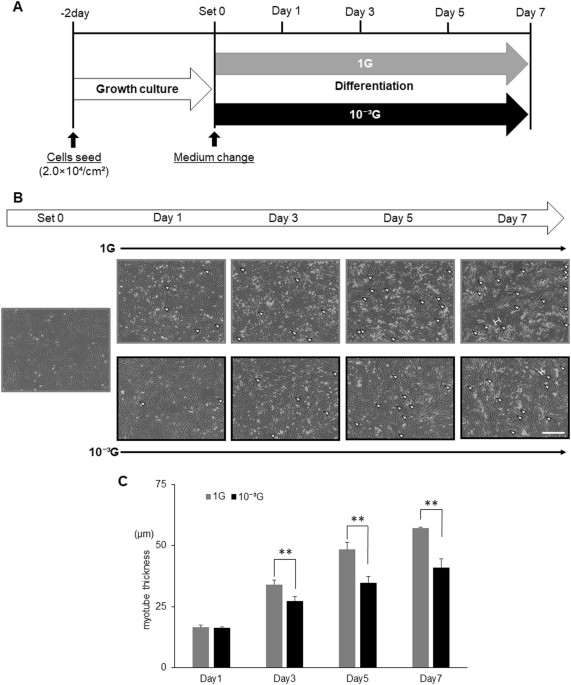
为了评估在模拟微重力条件下的肌生成,将L6细胞在正常1G或微重力(10 -3 G)条件 下用分化培养基培养 1,3,5或7天(图 1a )。 然后通过捕获图像观察细胞,并测量肌管细胞的最大横向直径(肌管厚度),如图 1b 所示 。 如所预期的,L6细胞分化成肌管,导致厚度增加,在1G条件下以孵育期依赖性方式(图 1c )。 有趣的是,尽管肌管逐渐增加,但在第3天,第5天和第7天,在微重力条件下,肌生成明显减弱(图 1c )。
微重力条件下肌生成的形态学评价。 显示了 实验时间过程的示意图。 将L6细胞用生长培养基培养2天,然后用分化培养基替换。 然后将细胞在正常的1G或10 -3 G条件下 培养 0,12 小时,1,3,5或7天,并通过拍照观察,并测量肌管细胞的最大横径(肌管厚度)。 。 b 显示了在肌生成过程中的代表性显微图像。 白色箭头:肌管细胞; 白色H形条:肌管细胞最大横径的实例; 白色比例尺:300μm。 C 通过图像处理软件ImageJ测量肌管细胞的最大横径,并计算10个视野的平均值。 列显示了三次独立实验的平均值; 酒吧,SD。 用Student t 检验 计算 P 值 。 (** P <0.01)( n = 3)
微重力条件下肌生成相关基因的基因表达分析
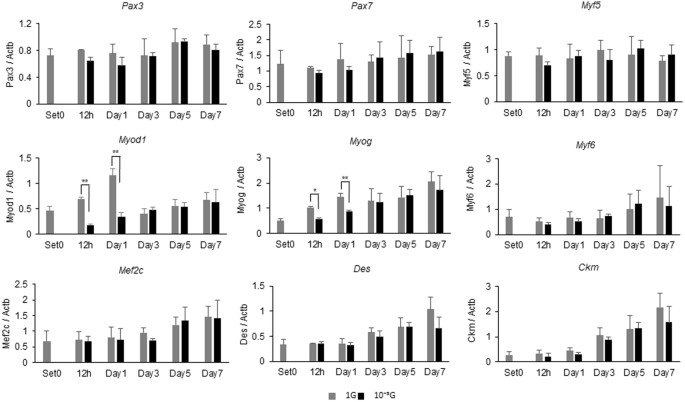
为了阐明微重力条件下肌肉生成减弱的分子机制,使用实时RT-PCR评估肌生成相关基因的表达水平(图 2 ): Myog , Myf6 , Mef2c , Des 和 Ckm的表达 。 1 G条件以潜伏期依赖性方式增加。 尽管 从1小时到第1天观察到在1G条件下 Myod1 表达的 瞬时增加, 但是 在微重力条件下这些增加被显着抑制。 在相同的时间点,微重力条件下 Myog 表达也被显着抑制。 Pax3的 表达水平 , Pax7 和 Myf5 在我们的研究条件下没有变化。
5-氮杂胞苷处理对微重力条件下肌肉生成的影响
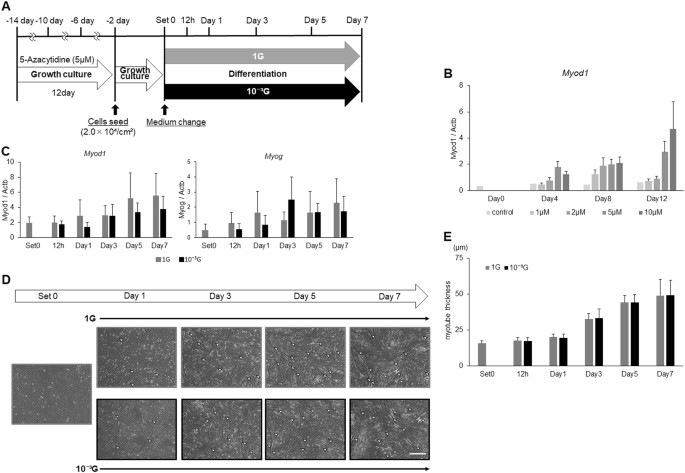
表达 MYOD1 并 生成素 此前曾报道了由DNA甲基化调控。 23 , 25 , 28 为澄清的表达减少的分子机制 MYOD1 和 生成素 ,和微重力条件下,在肌细胞生成的意义,L6细胞然后用DNA甲基化抑制剂,5-氮杂胞苷(5-氮胞苷),前处理与分化培养基一起孵育(图 3a )。 为了优化5-AzaC的浓度和治疗期,首先用1,2,5或10μM的5-AzaC处理L6细胞4天,8天或12天。 结果, Myod1 观察到表达以浓度或治疗期依赖性方式增加(图 3b )。 在这些条件中,用5μM的5-AzaC处理12天被确认为以下实验的有效条件。 用5μM的5-AzaC处理12天后,将L6细胞与生长培养基一起培养2天,并且还在1G或微重力条件下用分化培养基培养指定的时间。 实时RT-PCR结果显示,的表达水平 MYOD1 和 生成素 似乎在治疗依赖时期的方式逐渐增加,但1个G与10个之间的差 -3 图观察ģ条件 2 ,并且在图消失。 3C 。 在该实验条件下,还进行形态学评估,如图 1 所示 。 结果显示,尽管L6细胞在两种条件下逐渐分化成肌管,但在1G和微重力条件下肌管厚度的差异也完全消失(图 3d,e )。
5-氮杂胞苷处理对微重力条件下肌肉生成的影响。 显示了 实验时间过程的示意图。 将L6细胞与5μM的5-AzaC在生长培养基中培养12天,每4天传代一次。 然后将细胞接种在培养瓶上并在生长培养基中培养2天。 在用分化培养基替换培养基后,将细胞在正常的1G或10 -3 G条件下 培养 0,12 小时,1,3,5和7天。 b 进行5-azaC处理的优化。 用1,2,5或10μM的5-AzaC处理L6细胞4,8或12天,并检测 Myod1的 表达水平 通过实时RT-PCR评估基因。 平均三次独立测量,并计算相对基因表达水平,作为 每次实验的 Actb 表达 的比率 。 列显示了三次独立实验的平均值; 条形图,SD( n = 3)。 c 通过实时RT-PCR评估 Myod1 和 Myog 基因的 表达水平 。 平均三次独立测量,并计算相对基因表达水平,作为 每次实验的 Actb 表达 的比率 。 列显示了三次独立实验的平均值; 条形图,SD( n = 3)。 d 还显示了在肌生成期间的代表性显微图像。 白色箭头:肌管细胞; 白色H形条:肌管细胞最大横径的实例; 白色比例尺:300μm。 e 使用图像处理软件ImageJ测量肌管细胞的最大横径,并计算10个视野的平均值。 列显示了三次独立实验的平均值; 酒吧,SD。 ( n = 3)
微重力条件下 Myod1 基因的 DNA甲基化
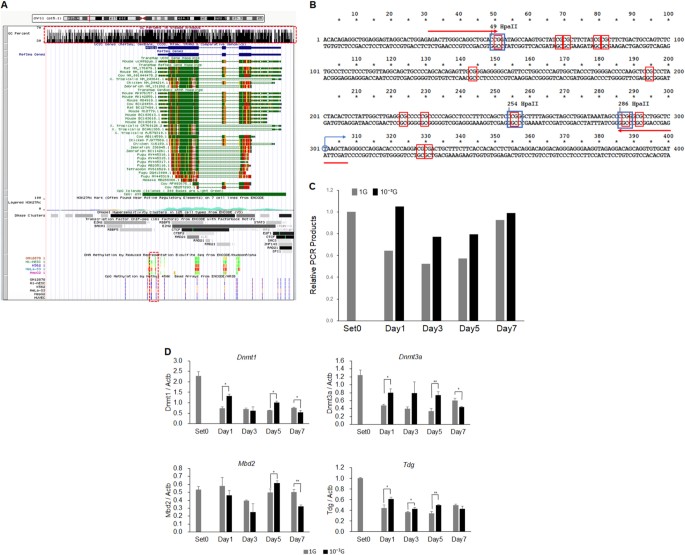
为了确定DNA甲基化是否实际上有助于 Myod1 表达的 调节 ,我们使用改良 的 HELP- 测定来检测 Myod1 基因 的启动子区域中的DNA甲基化 。 29 UCSC基因组浏览器( http://genome.ucsc.edu )显示 MYOD1 基因与CpG岛几乎重叠,表明非常密集的CpG位点,并且近端启动子区域实际上含有甲基化,如减少代表性亚硫酸氢盐测序和甲基450 K珠阵列(图 4a )。 在 Myod1 的转录起始位点的上游设计引物组 ,其含有12个CpG或3个 Hpa II位点(图2)。 4b )。 由于DNA甲基化敏感性限制酶 Hpa II不能消化甲基化DNA,但是/虽然可以消化未甲基化的DNA,但是引物组在用 Hpa II 孵育后扩增甲基化DNA,但不是未甲基化或消化的DNA 。 因此,甲基化DNA可以通过实时PCR定量,从而评估DNA甲基化状态。 然后从如图 1中 培养的L6细胞样品中分离基因组DNA ,并与 Hpa II 一起温育 12小时。 实时PCR证明,从1 G样品中扩增的PCR产物的相对量逐渐减少,直至第3天,然后增加至第7天(图 4c) )。 令人惊讶的是,来自微重力样品的PCR产物也略微降低,但程度小于1G,表明在 Myod1 启动子 上保留DNA甲基化 (图 4c )。 为了阐明潜在的机制,使用与图 2中 相同的cDNA样品进行甲基化相关基因的实时RT-PCR分析 。 结果显示, 在肌原性过程中,1G条件下 DNA甲基转移酶 Dnmt1 和 Dnmt3a的表达 降低(图 4d ), 而未检测到 Dnmt3b (数据未显示)。 有趣的是, Dnmt1 和 Dnmt3a的表达 在微重力条件下,在生肌过程中也降低了,但仍然显着高于1G条件下的那些,表明它们保留了甲基转移酶的功能(图 4d )。 在肌原性过程 中 Tdg的 表达水平 也降低,但1G和微重力条件之间的差异较小。 Mbd2的 表达水平 变化,没有观察到趋势。
微重力条件下 Myod1 基因的 DNA甲基化 。 UCSC基因组浏览器 中 MYOD1 基因 的 示意结构 显示, MYOD1 基因与CpG岛(红色虚线上方绘制的上部矩形)实际上重叠,表明CpG位点非常密集,近端启动子区域实际上包含甲基化位点(下部矩形以红色绘制)虚线)。 b 显示了 Myod1 基因 中近端启动子区的核酸序列 。 蓝色圆圈和箭头表示 Myod1 基因的 转录起始位点 ,红色矩形,CpG位点,蓝色矩形, Hpa II位点和红色箭头,用于修饰的HELP测定的引物组。 c 通过实时PCR定量 Myod1 基因中的 甲基化近端启动子区域 。 平均三次独立测量,并计算每种实验的PCR产物的相对量与Set0的比率。 ( n = 3)。 d 通过实时RT-PCR评估甲基化相关基因的表达水平。 平均三次独立测量,并计算相对基因表达水平,作为 每次实验的 Actb 表达 的比率 。 列显示了三次独立实验的平均值; 酒吧,SD。 用Student t 检验 计算 P 值 。 (* P <0.05,** P <0.01)( n = 3)
在微重力条件下 对 Myod1 和 Myog 基因的 其他调节
为了阐明 在1G和微重力条件下肌原性过程 中 Myod1 和 Myog 基因 表达的调节机制 ,进行了启动子活性和RNA稳定性的进一步分析。 首先,的1.47 kb的DNA片段 MYOD1 基因启动子区,或所述的1.55 kb的DNA片段 生成素 基因启动子区,扩增并亚克隆到荧光素酶报告质粒pGL4.16(指定pGL4.16-MYOD1 Pro1474或pGL4。 16-Myog Pro1546,补充图 1B )。 然后用这些启动子报告基因转染L6细胞并孵育1天。 接下来,用分化培养基替换生长培养基,并在1G或微重力条件下再培养一天(补充图 1A )。 双荧光素酶测定证明,与空载体相比,克隆区域具有强启动子活性,但未观察到在1G或微重力条件下那些活性的任何差异(补充图 1C )。 接着将L6细胞在生长培养基中培养2天,然后在分化培养基中再培养一天。 加入5μg/ ml放线菌素D后,在1G或微重力条件下培养细胞(补充图 2A )。 实时RT-PCR显示基因表达水平 Myod1 逐渐减少,而 Myog 和 Actb 则没有(补充图 2B )。 在1G或微重力条件下这些水平没有差异(补充图 2B )。
讨论
由于人口老龄化,表现出骨骼肌萎缩和虚弱的老年人数量正在增加,成为社会关注的焦点。 30 , 31 , 32 为达到更好的治疗结果,肌形成的分子机制的理解是必不可少的,因为受损肌发生密切与年龄相关的骨骼肌损失和虚弱相关联。 5 , 6 , 7 , 8 以前的报道表明,生物力学信号在肌生成调节中起重要作用。 具体地,已经发现成肌细胞和肌肉卫星细胞暴露于机械拉伸,电刺激或微重力可以改变MRF的表达水平,导致肌生成的改变。 15 , 16 , 17 , 19
在这项研究中,我们使用我们的新代3D-回转器“Gravite ® ”,以获得模拟的微重力条件下(10 -3 用于细胞培养G):我们观察到的大鼠成肌细胞(L6细胞)培养Gravite的肌生成 ® 被显著衰减,表明成功创造了微重力条件(图 1 )。 在1G条件下在分化培养基中培养的L6细胞通常以孵育期依赖性方式分化成肌管。 然而,在第3天至第7天的微重力条件下,L6细胞的肌生成显着减弱,尽管肌管逐渐增加,表明在微重力条件下肌细胞发生延迟(图 1) )。 由于肌生成受到MRF的顺序激活的调节,因此通过实时RT-PCR评估肌生成相关基因的表达水平。 结果显示 , 在1G条件下 Myod1 , Myog , Myf6 , Mef2c , Des 和 Ckm的 表达 以孵育期依赖性方式增加(图 2 )。 其中, 在1G条件下 Myod1 表达在早期阶段(从12小时到第1天)显示出独特的瞬时增加,表明肌原性过程开始。 和 Myod1的 表达 ,以及 Myog 在微重力条件下被强烈抑制,表明这些抑制可能直接影响肌生成的起始,如图 1 所示 。 这些显着的结果表明我们的实验模型可用于分析微重力条件下的生物和分子机制。
为了阐明 Myod1 和 Myog 表达降低的分子机制 及其在微重力条件下在肌生成中的重要性,首先用不同剂量的DNA甲基化抑制剂(5-AzaC)处理L6细胞不同的孵育期以优化实验条件。 如所预期的, 尽管用10μM的5-AzaC处理显示出轻微的毒性作用,但 Myod1 表达以浓度或处理期依赖性方式增加。 因此,我们决定尝试用5μM的5-AzaC处理12天作为以下实验的有效条件。 实时RT-PCR显示 Myod1 和 Myog的 表达水平 似乎在治疗期依赖性方面逐渐增加,但是 在图 2中 看到的早期 Myod1 的短暂增加 消失了。 和在表达水平上的差异 MYOD1 和 生成素 1 G和10个之间 -3 ģ条件也消失了。 此外,在实验条件下,1 G和微重力条件下肌管厚度的差异完全消失,这表明修改DNA甲基化状态对于 在微重力条件下 调节 Myod1 和 Myog的 肌生成和表达 至关重要 (图 3d,e )。 这些结果表明,DNA甲基化是重力调节肌细胞生成的关键因素,可能是治疗骨骼肌功能障碍和肌肉减少症的分子靶点。
UCSC基因组浏览器表明 MYOD1 基因与CpG岛几乎重叠,表明CpG位点非常密集,近端启动子区实际上含有甲基化位点(图 4a )。 事实上,我们的改良HELP测定显示甲基化的 Myod1 启动子逐渐减少(PCR产物减少)直至第3天,然后增加直至第7天。 这些DNA甲基化状态的动力学变化显然有助于 Myod1 在肌生成起始过程中的 表达增加 。 此外,这些DNA甲基化状态的动态变化在微重力条件下减弱,表明微重力调节肌 细胞 生成和 Myod1 通过控制DNA甲基化状态来表达。 Dnmt1 和 Dnmt3a 的mRNA表达 进一步证明DNA甲基转移酶中的表达水平可能导致微重力条件下DNA甲基化状态的差异。
辛格等人。 据报道,模拟微重力 在72小时时 增加了 DNMT1 , DNMT3a 和 DNMT3b的 表达水平 ,并 在人T淋巴细胞中7天时降低了它们。 此外,甲基化敏感随机扩增多态性DNA(MS-RAPD)分析显示,模拟微重力暴露导致DNA低甲基化和突变。 27 在我们的研究中,用相似的动力学,增加的水平 DNMT1 和 化酶Dnmt3a 在1-5天,并在观察7天水平降低,但DNA甲基化状态应具有相反的作用:甲基化导致降低的表达 MYOD1 和肌发生的延迟。 的影响 Tdg 动力学与DNA甲基化状态不一致。 这些差异可能是由于细胞类型,培养系统,甲基化检测方法或靶基因的差异。 虽然我们的研究结果似乎一致,但有必要进一步调查以澄清结果。 评估启动子活性和mRNA稳定性的其他实验也支持 Myod1 在肌肉生成中 的表观遗传调节 和在改变的重力条件下的MRF表达的重要性。
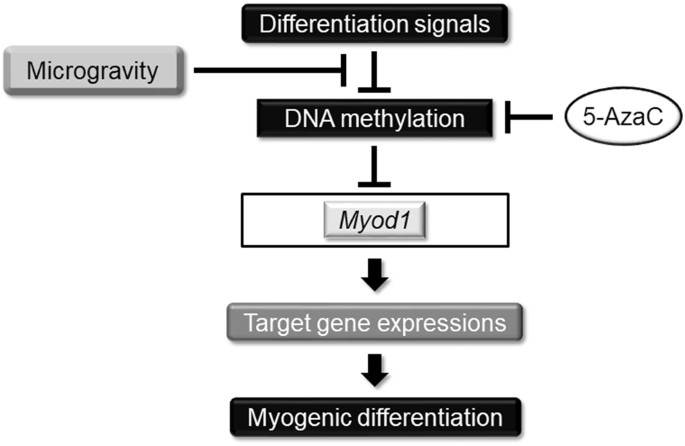
总之,我们证明模拟微重力通过控制 Myod1的 DNA甲基化状态减弱了肌肉生成 (图 5 )。 值得注意的是,DNA甲基化抑制剂减弱了微重力对肌生成的抑制作用,表明抑制剂作为肌肉萎缩和虚弱的分子靶向治疗的潜力。 虽然这项研究主要集中在生物学观点上,但进一步分析包括外部物理化学参数的影响可能会为肌生成的分子机制提供新的见解,也可能为临床上与年龄相关的骨骼肌功能障碍的分子靶向治疗的发展提供新的见解。相。
材料和方法
细胞培养
大鼠成肌细胞L6细胞获自Health Science Research Resources Bank(日本大阪),并用Dulbecco改良的Eagle's minimal essential medium-High glucose(DMEM-H)(NACALAI TESQUE,Inc.,Kyoto,Japan)维持,含10如前所述,%胎牛血清(FBS; BioWhittaker,Verviers,比利时),100U / ml青霉素和0.1mg / ml链霉素(Sigma,St.Louis,MO,USA)。 17 细胞用生长培养基培养2天,然后在达到亚汇合后用含有DMEM-H,2%FBS,100U / ml青霉素和0.1mg / ml链霉素的分化培养基替换。 然后将细胞在正常1 G或10种培养 -3 ģ条件下,利用“Gravite ® ”(空格生物实验室有限公司,广岛,日本)。
对于表达分析,将细胞在正常的1G(组1G)或 10-3G 条件(组 10-3G )下培养0,12小时,1,3,5或7天。 然后收获细胞并储存在-80℃直至使用。 L6细胞也与5μM的5-氮杂胞苷(5-AzaC,Wako Pure Chemical Industries,Ltd.,Osaka,Japan)在生长培养基中培养12天,每4天传代一次。 然后将细胞接种在12.5cm 2 培养瓶上并在生长培养基中培养2天。 用分化培养基替换培养基后,将细胞培养在正常的1G或10 -3中 G条件。 在0,12小时,1,3,5和7天进行形态学观察和收获,并储存在-80℃直至使用。 方法按照有关规定和指南进行。
Gravite ®
微重力条件可以通过太空飞行或自由落体产生; 为了模拟微重力,我们使用了新开发的Gravite®(Space Bio-Laboratories Co.,Ltd。),如先前的专利(未分化的多能干细胞增殖/分化调节方法和系统,专利号8034616B2(US),2515552(CA) ),1577380(EPC:GB,FR,DE,IT,SE),ZL02830112.9(CN),和O731940(KR),以及重力控制器,专利号623009(JP),US9494949B2(美国)并在欧盟授权)。 该装置产生类似于外层空间的环境(10 -3 G)通过围绕两个轴旋转样本,将重力矢量与时间轴积分。 这是通过在装置中心旋转腔室来实现的,导致重力矢量在球形体积内均匀分散,具有恒定的角速度。 这些特定条件 在8分钟内 产生了10 -3 G 的模拟环境, 实际上是通过重力加速度传感器测量的,并且它被定义为模拟微重力(10 -3 G)。 33 , 34 , 35
分析肌细胞生成
为了评估肌生成,通过在1G或10 -3 G条件下 孵育 指定时期 后使用倒置相差显微镜(Eclipse,Nikon,Japan)拍摄10个视野来观察细胞 。 通过图像处理软件ImageJ测量肌管细胞的最大横径,并计算10个视野的平均值。
RNA制备和实时RT-PCR
总RNA从使用NucleoSpin冷冻的细胞沉淀提取 ® RNA II试剂盒根据制造商说明书(MACHEREY-NAGEL,Düren的,德国)。 使用High-Capacity cDNA Archive TM试剂盒(Applied Biosystems,Foster City,CA,USA)逆转录从每个细胞系中提取的2微克总RNA。 使用引物(最终浓度为200nM)和MGB探针(终浓度100nM,通用探针库:UPL,Roche Diagnostics,Tokyo,Japan)对1/200稀释的cDNA进行实时RT-PCR。 )(显示在S1表中)使用FastStart Universal Probe Master(ROX)(罗氏诊断)进行设置,使用 Actb 定量基因表达 作为内部管家控制。 使用7500 Real-Time PCR System(Applied Biosystems)在以下标准条件下进行PCR反应:平均三次独立测量,并计算相对基因表达水平,作为 每次实验的 Actb 表达 的比率 。
DNA提取和甲基化分析
基因组DNA从使用NucleoSpin冷冻的细胞沉淀中分离 ® 根据制造商说明书的组织(MACHEREY-NAGEL)。 将总共50μl反应混合物中的50ng基因组DNA用甲基化敏感性 Hpa II在37℃ 消化 12小时,然后使用引物组对2μl反应混合物进行实时PCR(如S2表所示)以扩增包括CpG位点的片段 MYOD1 启动子区域与ITAQ ® 带ROX的SYBR™Green Supermix(BIO-RAD,Hercules,CA,USA)。 使用7500 Real-Time PCR System(Applied Biosystems)在以下标准条件下进行PCR反应:平均三次独立测量,并计算相对基因表达水平与Set0处样品DNA的比率。
质粒构建和荧光素酶报告实验
Myod1 基因 的 1.47kb DNA片段 (来自转录起始位点+1的-1264至+210)或 Myog 基因 的 1.55kb DNA片段 (来自转录起始位点 的 +1512 至+34 + 1)通过PCR扩增(引物组示于表S3)从L6基因组DNA,并将它们克隆到荧光素酶报告质粒pGL4.16(Promega公司,麦迪逊,WI,USA)(指定pGL4.16-MYOD1 Pro1474或pGL4.16 -Myog Pro1546)。 将L6细胞接种在培养瓶上,并在生长培养基中培养一天。 记者随后构建物瞬时转染到使用的TransIT L6细胞 ® -LT1 Transfection Reagent(TaKaRa Bio,Inc.,Shiga,Japan)。 海肾荧光素酶载体(pRL-SV40,Promega)用作转染效率对照。 培养一天后,用分化培养基替换生长培养基,并在1G或10 -3 G条件 下再培养一天 。 使用单样品发光计,Biolumat LB 9505(BERTHOLD TECHNOLOGIES GmbH&Co.KG,Bad Wildbad,Germany)和双荧光素酶报告分析系统(Promega)测量荧光素酶发光。 将启动子活性计算为萤火虫与海肾荧光素酶读数的比率,并计算至少三次独立实验的平均值。 方法由广岛大学基因重组实验安全委员会批准。
mRNA稳定性分析
将L6细胞接种在培养瓶上,并在生长培养基中培养。 2天后,用分化培养基替换生长培养基并再培养一天。 向培养基中加入5μg/ ml的放线菌素D(NACALAI TESQUE)后,将细胞在1G或10 -3 G条件下培养指定的时间段(0,15,30,45,60或120分钟)。 从每个收获的细胞制备总RNA ,并 使用如上所述的实时RT-PCR方法分析 Myod1 , Myog 和 Actb的 基因表达 。
统计分析
使用STATVIEW进行所有统计检验 ® 5.0版软件(SAS Institute公司,NC,USA)和Microsoft ® 的Excel ® 的Mac版本12.3.6。 学生 t 检验用于确定 P值 (* P <0.05,** P <0.01)。
数据可用性
所有相关数据均可从相应作者处获得。